中成薬事業
大切なお客様に製品を
届けるまで
Product Offerings
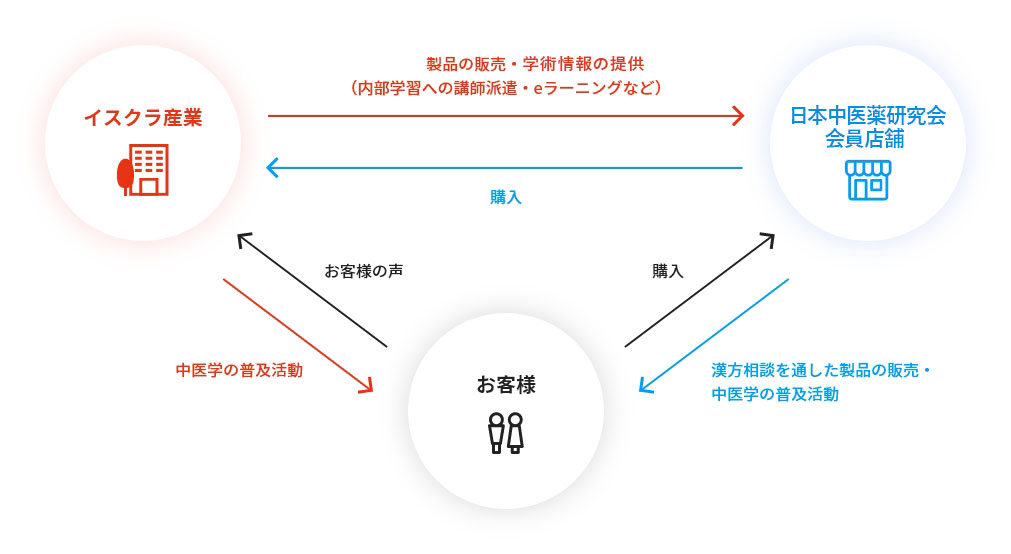
日本中医薬研究会会員店向け販売
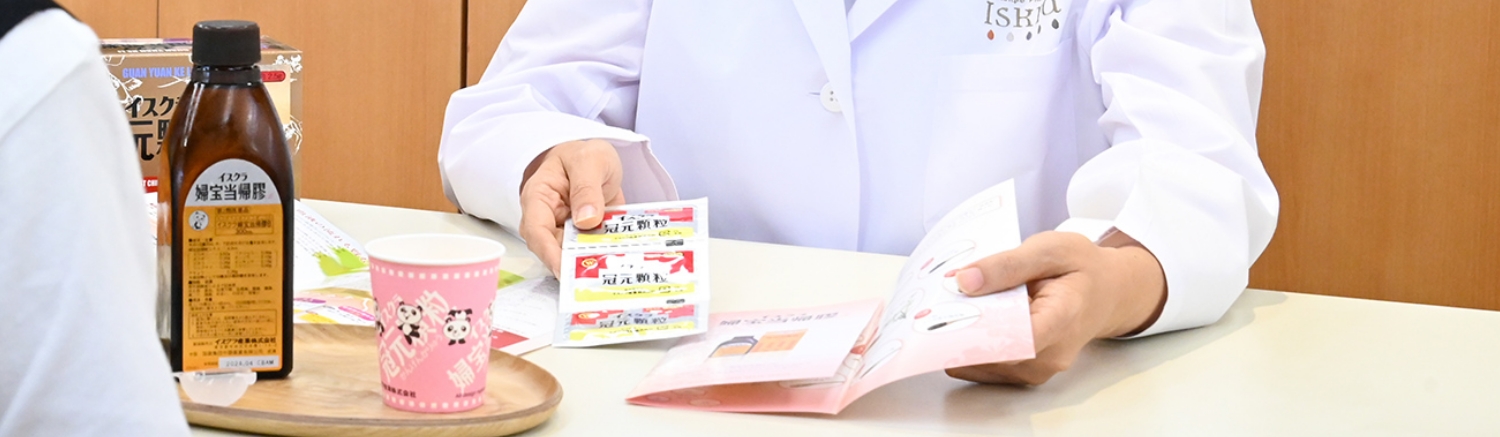
日本では西洋医学による対症療法が一般的ですが、セルフメディケーションへの需要とともに、予防医学を得意とする「中医学」が注目されています。中医学では、体調不良の原因を体全体のバランスから捉えるため、同じ病気でも対処法が異なり、また、違う病気でも対処法が同じになることがあります。日本中医薬研究会は、西洋医学だけでなく、西洋医学とは異なる理論体系を持つ中医学の研鑽を積み、症例や臨床での経験を生かしながら、人々の健康に貢献する専門家集団(薬局・薬店)です。
弊社の営業活動は、中成薬(中医学理論に基づいた処方により製造された薬)などの単なる販売だけでなく、学術交流や販売促進のお手伝いを通して、「中医学で人々の健康に寄与する」という同じ志を持った会員店の良き相談相手になるよう努めています。営業部員の他に、15名前後の中医学講師(中医学の本場中国の中医薬大学を卒業した中医学の専門家)が在籍し、「中医学の普及」に重きを置いた営業活動に日々取り組んでいるのが特徴です。
一人でも多くの方が中医学・中成薬を知り、試し、その良さを実感し、そして健康であることの幸せを存分に感じていただくために、日本中医薬研究会に所属する全国約1000店舗の薬局・薬店の先生方と共に日々研鑽を重ねています。
薬局薬店・DgS・
通販企業向け一般用医薬品販売
全国の薬局薬店、大手ドラッグストア向けに一般用医薬品「イスクラ華陀膏Y」「華陀雪華晶」を、代理店を通じて販売しています。
華陀膏は、1966年にイスクラ産業が初めて輸入販売を手掛けた医薬品です。また、中国の医薬品を輸入販売するきっかけとなったものです。それから既に半世紀が過ぎていますが、今でも多くの人に愛され、当時の精神を忘れずに販売し続けています。
医薬品・健康食品・化粧品メーカー向けOEM製造
中国の自社工場「四川華星薬業有限公司」では、各種の生薬エキス原料や漢方製剤、生薬製剤のOEM製造が可能です。
対応可能な生薬エキス
- 漢方生薬製剤の一括抽出エキス末
- 単味生薬エキス末全般
- 局外生規や別紙規格の生薬抽出エキス末
- 生薬抽出濃縮エキス(液体)(比重指定可能)
- その他(食品用や化粧品用エキス末)

200型流動層造粒機
対応可能な生薬エキス
- 漢方生薬製剤の一括抽出エキス末
- 単味生薬エキス末全般
- 局外生規や別紙規格の生薬抽出エキス末
- 生薬抽出濃縮エキス(液体)(比重指定可能)
- その他(食品用や化粧品用エキス末)
自社工場での製造の特徴は「安全安心の製品ができあがるまで」をご覧ください。
医薬品メーカー向けOEM製造に関するお問い合わせはこちら